Коррозия и защита
КОРРОЗИЯ И ВИДЫ ЗАЩИТНЫХ ПОКРЫТИЙ
КОРРОЗИЯ И ВИДЫ ЗАЩИТНЫХ ПОКРЫТИЙ
Коррозией называется процесс разрушения металлов при их химическом,электрохимическом или биохимическом взаимодействии с окружающей средой.
Процесс коррозии сопровождается окислением металла и превращением его в различные химические соединения (окислы, гидроокиси, карбонаты и т. п.).
Черные металлы - углеродистая сталь, чугуны - наиболее интенсивно подвергаются коррозии, тогда как многие цветные металлы и легированные стали весьма устойчивы в атмосферных условиях и агрессивных средах.
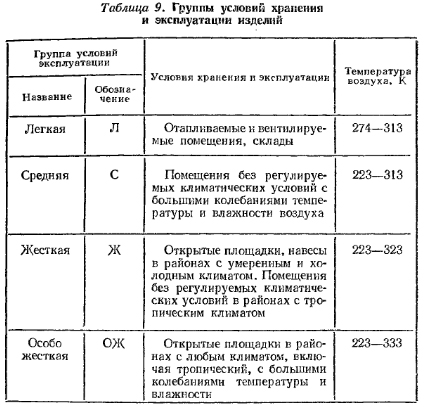
Характеристика групп условий эксплуатации изделий представлена в табл.9.
Количественно скорость коррозии можно выразить массовым показателем К,который определяет количество растворившегося металла с единицы поверхности за установленный период времени, например 0,4 г/(м2*ч).
ГОСТ 13819-68 предусматривается оценка скорости коррозии глубинным показателем коррозии П, выражающим глубину коррозионного поражения в единицу времени.
Таблица9. Группы условий хранения и эксплуатации изделий

Зависимость между величинами П и К определяется формулой
П=8.76*К/γ,
где К - массовый показатель, г/(м^2*ч); γ - плотность металла, г/см3.
ГОСТ 13819-68 рекомендована 10-балльная шкала коррозионной стойкости металлов, приведенная в табл. 10.
Относительная оценка коррозионной устойчивости некоторых металлов в различных средах дана в табл. 11.
Коррозия, как правило, протекает неравномерно и часто носит местный(точечный) или межкристаллитный характер. Коррозионное разрушение происходит обычно на участках поверхности, имеющих неоднородную структуру или характеризующихся наличием разнородных частиц, например частиц феррита и цементита в углеродистых сталях.
Таблица 10. Десятибалльная шкала коррозионной стойкости металлов
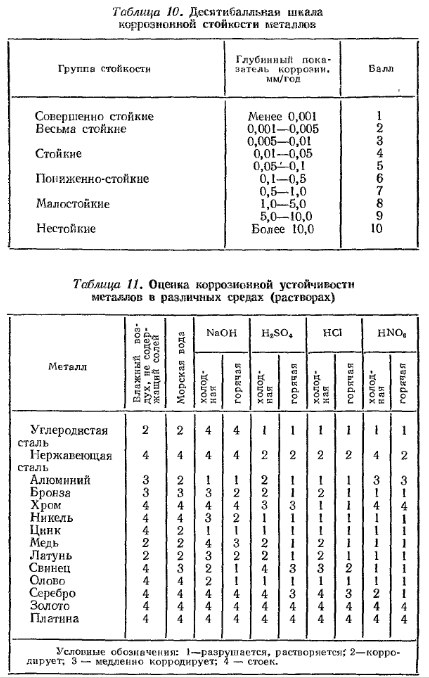
Таблица 11. Оценка коррозионной устойчивости металлов в различных средах (растворах)
На скорость коррозии оказывают большое влияние состав среды, ее электропроводность, а также электродные потенциалы металлов или каких-либо частиц, находящихся в контакте с металлами. Электродный потенциал возникает на металле каждый раз, как только металл попадает в жидкую электропроводную среду,т. е. в воду, в которой растворены какие-либо вещества (соли, кислоты, щелочи).
В результате перехода металла в раствор в виде ионов или же адсорбции металлом ионов из раствора металл приобретает электрический заряд, обусловливающий возникновение на нем электрического потенциала.
Для оценки свойств металла, определяющих его поведение в процессах коррозии, можно пользоваться значением стандартного электродного потенциала, т.е. потенциала, который возникает при погружении металла в раствор его соли,содержащей один грамм-ион данного металла в литре раствора.
Значения стандартных электродных потенциалов приведены в табл. 12
При контакте двух различных металлов в жидкой электропроводной среде за счет возникающей разности электродных потенциалов создается гальванический элемент (гальванопара), схематически представленный на рис. 1.
Если оба металла соединить проводником, по которому электроны перемещаются от более отрицательного электрода к менее отрицательному (от Ме1 к Ме2), как показано на рис. 1 стрелкой, то первый металл начнет растворяться вследствие непрерывного перехода его в раствор в виде ионов.
Растворимый электрод называют анодом, роль которого в гальваническом элементе выполняет отрицательно заряженный электрод, в отличие от электролизной ячейки, где под действием электрического тока от внешнего источника растворимым электродом (анодом) является положительно заряженный электрод.
Анодное растворение металла в результате действия гальванопары является одним из главных факторов, ускоряющих процесс коррозии, поэтому в конструкциях приборов, машин и различных сооружениях недопустимо сопряжение металлов, обладающих значительной разностью потенциалов.
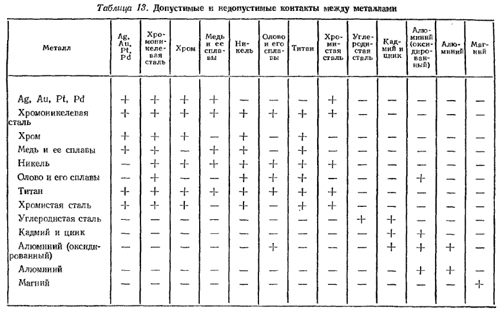
В табл. 13 приведены данные о допустимых и недопустимых парах сопрягаемых металлов в конструкциях, рассчитанных на эксплуатацию в жестких условиях. Знаком «+» отмечены допустимые пары, а знаком «-» - недопустимые.
При нанесении металлических покрытий на деталях приборов и машин создаются сопряжения разнородных металлов, и для обеспечения надежной защиты от коррозии деталей используют такое покрытие, которое в паре с металлом детали будет служить анодом (анодное покрытие). Так, для стальных деталей анодными покрытиями являются цинк, кадмий, алюминий, и в том случае, если в поры покрытия или в места его повреждения проникнет влага и начнется коррозионный процесс, растворению будет подвергаться не металл детали, а покрытие.
Таблица 13. Допустимые и недопустимые контакты между металлами

Существуют различные способы защиты изделий от коррозии; к наиболее распространенным относятся защитные покрытия: металлические, химические,лакокрасочные и эмалевые.
В зависимости от способа нанесения металлические покрытия могут быть электролитические (гальванические), горячие, диффузионные и т. п.
Гальванические покрытия получают посредством выделения металлов из растворов их солей под действием электрического тока. Покрываемые детали служат катодами, а анодом - вспомогательный электрод, подключенный к положительному полюсу источника тока.
Химические покрытия представляют собой пленки определенного химического состава, которые образуются на металле в результате воздействия на него химических реагентов. Наиболее распространены оксидные и фосфатные пленки.


